编者按
在心血管疾病(CVD)防治领域,脂蛋白(a) [Lp(a)]正逐渐成为研究热点。近年来,相关研究成果不断涌现,持续拓展着CVD风险评估、发病机制探索及临床干预策略的边界。本文聚焦第93届欧洲动脉粥样硬化学会年会(EAS 2025)期间围绕Lp(a)的前沿研究动态,深度剖析中国科研团队的卓越贡献以及全球范围内的研究进展,同时对Lp(a)检测、级联筛查等临床应用关键环节展开深入探讨,旨在为心血管领域的科研工作者、临床医师以及关注心血管健康的专业人士提供全面、权威且具有前瞻性的学术信息,推动CVD防治领域的学术交流与实践发展。
急性心肌梗死防治新视角——中国专家的Lp(a)探索

Lp(a)升高会增加急性心肌梗死(AMI)发生风险,而斑块在AMI中发挥重要作用。中国专家开展了一项聚焦Lp(a)与AMI患者冠状动脉粥样硬化斑块特征关联的研究[1],旨在深入剖析AMI患者中Lp(a)与通过三支血管光学相干断层扫描(OCT)检测出的冠状动脉粥样硬化斑块特征的关系。研究采用回顾性分析,选取2017年1月至2021年12月成功干预后接受三支血管OCT成像的1005例AMI患者,测定Lp(a)水平,Lp(a)≥75 nmol/L视为升高。并获取患者临床和斑块特征数据,借助逻辑回归模型分析二者关联。主要终点为是否存在薄纤维帽粥样硬化斑块(TCFA)。
结果显示,患者平均年龄56.6±11.5岁,75.0%为男性,15.3%患者Lp(a)≥75 nmol/L(图1)。与Lp(a)<75 nmol/L患者相比,Lp(a)升高患者的非罪犯斑块破裂发生率更高(26.0% vs. 16.7%,P=0.006),TCFA发生率更高(41.6% vs. 32.1%,P=0.022),巨噬细胞积聚更多(P=0.049),微血管也更多(P=0.047)(图2)。

图1. AMI患者基线Lp(a)分布
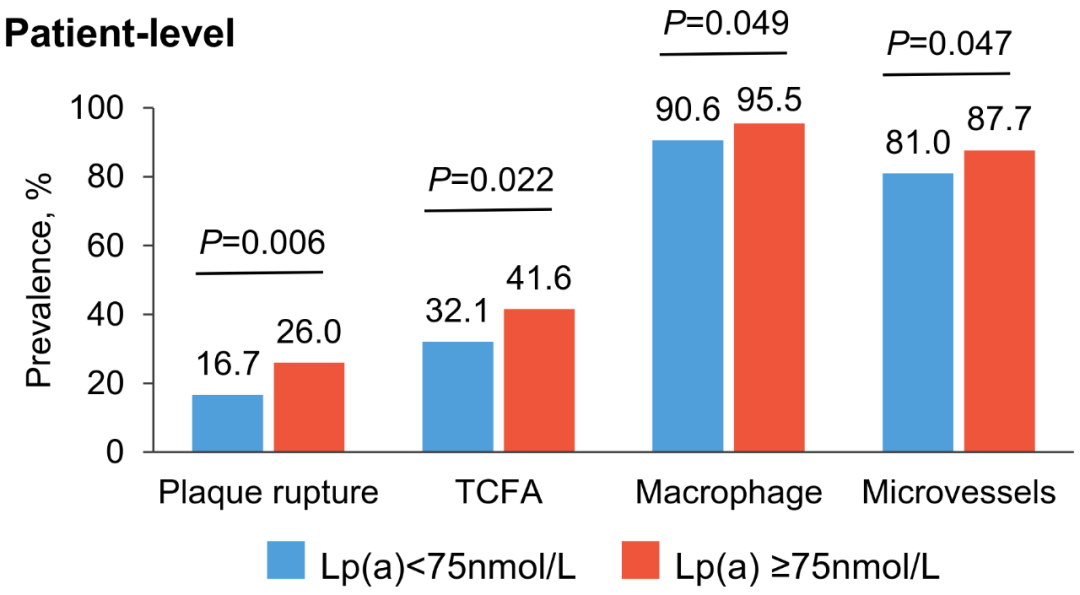
图2. 患者层面不同Lp(a)水平的斑块破裂、TCFA、巨噬细胞及微血管的发生率
病变层面,Lp(a)升高组非罪犯斑块破裂发生率更高(7.5% vs. 5.1%,P=0.028),巨噬细胞积聚也更多(89.1% vs. 85.4%,P=0.042)(图3)。调整协变量后,Lp(a)升高与非罪犯斑块破裂(OR 1.90,95%CI:1.24~2.91,P=0.003)以及TCFA(OR 1.68,95%CI:1.13~2.51,P=0.011)独立相关。
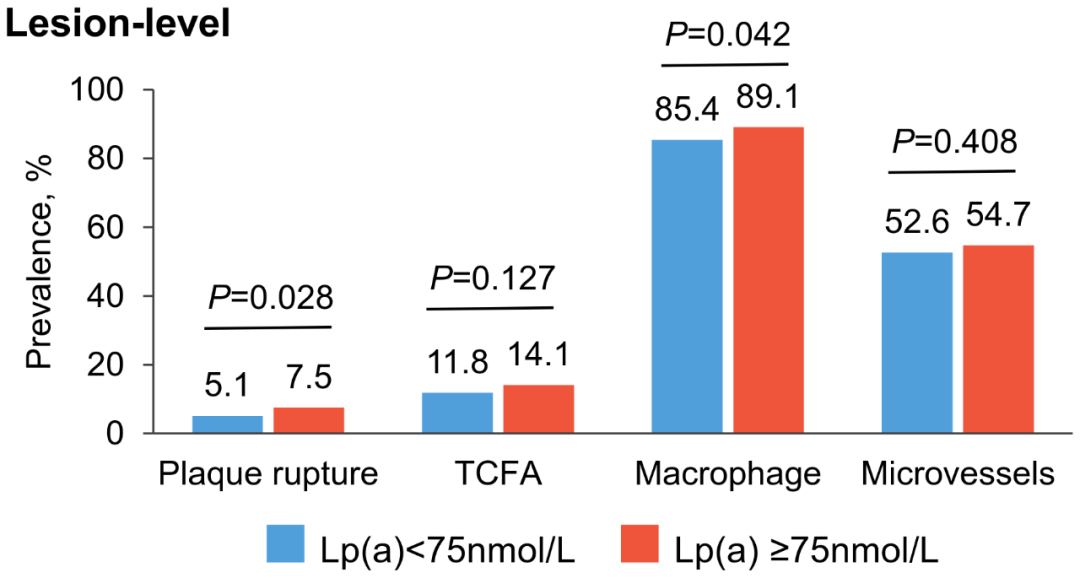
图3. 病变层面不同Lp(a)水平的斑块破裂、TCFA、巨噬细胞及微血管的发生率
这一研究证明了在AMI患者中,Lp(a)≥75 nmol/L能够独立预测非罪犯斑块破裂和TCFA,Lp(a)升高会增加斑块易损性。
国际研究进展:全球视野下Lp(a)与CVD的关联探索
CVD防控领域,Lp(a)作为独立于传统风险因素的致动脉粥样硬化脂蛋白备受关注,尽管尚无特异性降Lp(a)药物获批,但其在不同人群中的影响通过多项研究逐渐明晰。近期,3项国际研究聚焦急性冠脉综合征(ACS)患者、普通人群及早发动脉粥样硬化性心血管疾病(ASCVD)群体,为Lp(a)的风险分层与精准管理提供关键证据。
希腊CALLINICUS-Hellas注册研究[2]在ACS患者中探索了入院时Lp(a)水平与短期不良结局的关联。研究纳入1133例ACS患者,按Lp(a)基线水平分为<70 mg/dL(A组)与≥70 mg/dL(B组),随访6个月评估复合终点(非致死性心肌梗死、非致死性卒中、心源性死亡,3P-MACE)。结果显示,B组多支冠状动脉病变比例更高(56% vs. 45%,P=0.03),且3P-MACE发生率显著升高(HR 1.93,95%CI:1.12~3.29,P=0.02)(图4),证实Lp(a)≥70 mg/dL是独立于传统因素的风险预测因子。该研究表明,在ACS二级预防中,Lp(a)≥70 mg/dL可作为识别高危患者的生物标志物,提示需更严密监测与个体化干预。
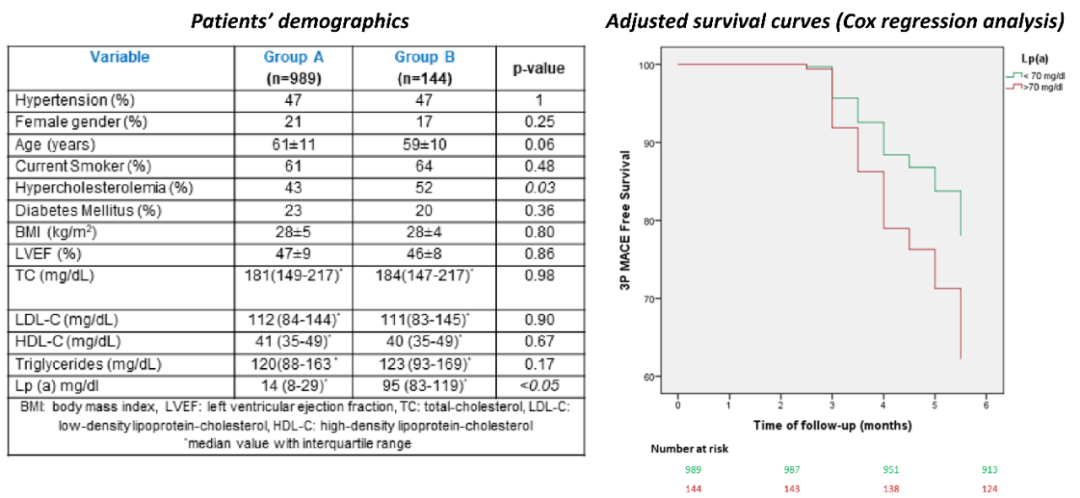
图4. 患者特征及调整后的生存曲线(多元回归分析)
欧洲多队列研究[3]则关注普通人群,旨在比较Lp(a)升高与冠心病(CHD)事件的关联是否因传统风险因素(高血压、糖尿病、血脂异常、吸烟)负荷不同而改变。研究纳入66 495例无CHD病史成人,按基线0/1个或≥2个传统风险因素分层,通过竞争风险模型分析Lp(a)≥90百分位数与未来CHD事件的关系。结果显示,中位随访9.7年期间,3467例发生CHD。基线仅0/1个风险因素的“极低危”人群中,Lp(a)升高者的CHD风险(sHR 1.38,95%CI:1.12~1.71)与≥2个风险因素人群(sHR 1.27,95%CI:1.10~1.46)相当,且两组风险无显著差异。这表明,Lp(a)的致CHD效应具有“广谱性”,即使传统风险极低,高水平Lp(a)仍带来显著风险,挑战了“低危人群无需关注Lp(a)”的认知,提示未来风险评估模型需纳入这一指标。
美国基于电子健康记录的真实世界研究[4]聚焦早发ASCVD患者,旨在分析其Lp(a)水平及种族差异。研究回顾性纳入11 310例ASCVD患者,其中2684例为早发患者(男性<55岁、女性<65岁发病),根据Lp(a)水平分组并将≥125 nmol/L和≥175 nmol/L分别定义为Lp(a)升高和显著升高,比较其在早发与非早发ASCVD患者中的患病率。结果显示,早发ASCVD患者中29.7%的人Lp(a)≥125 nmol/L、21.2%的人Lp(a)≥175 nmol/L,均显著高于非早发ASCVD患者,非裔美国人早发ASCVD患者中50.1%的人Lp(a)≥125 nmol/L、37.7%的人Lp(a)≥175 nmol/L,远高于其他种族,且早发ASCVD患者更年轻、女性比例更高、基线LDL-C水平显著升高(图5)。研究结论指出,约1/3早发ASCVD患者存在Lp(a)升高,非裔人群尤为突出,提示对早发患者常规检测Lp(a)可挖掘潜在遗传风险,助力个体化预防策略,关注种族差异或能减少健康不平等。

图5. 早发与非早发ASCVD患者中Lp(a)升高的患病率
以上3项研究从二级预防、全人群风险及早发与种族差异维度勾勒出Lp(a)的临床画像,启示临床在ACS患者中需将Lp(a)≥70 mg/dL作为强化随访信号,在全人群中即使传统风险低,也应警惕Lp(a)升高,对早发及非裔人群更应将Lp(a)检测纳入风险评估必选项。随着新型药物进入临床阶段,Lp(a)管理从“不可干预”走向“可干预”。
优化心血管风险评估的关键环节——Lp(a)检测与筛查的深度剖析
随着Lp(a)在CVD风险评估中的重要性日益凸显,准确、规范的Lp(a)检测以及合理的级联筛查策略成为临床实践中的关键环节。在CVD综合管理中,精准检测Lp(a)对于早期识别高危人群、制定个体化防治方案具有重要意义。然而,目前在Lp(a)检测的标准化、测量单位换算的一致性以及临床应用的规范化等方面仍面临诸多挑战。
由于Lp(a)独特而复杂的分子结构,直接进行单位转换并不被推荐。然而,在临床数据管理与分析等特定场景中,近似的单位转换具有一定实用价值。为此,研究人员对阿根廷Lp(a)研究小组登记的首批2000例患者的详实数据展开深入分析,采用3种既往已报道方法将初始以nmol/L为单位测量的Lp(a)浓度转换为mg/dL:①固定转换因子(Fixed conversion factor):1 mg/dL=2.42 nmol/L;②基于范围的因子(Range-based factors):将Lp(a)浓度分成6个范围,<75 nmol/L时÷1.82,75~175 nmol/L时÷2.325,175~225 nmol/L时÷2.62,225~275 nmol/L时÷2.80,275~325 nmol/L时÷3.0,≥325 nmol/L时÷3.64;③基于方程的转换(Equation-based conversion):Lp(a)nmol+3.83/2.18。结果显示,在Lp(a)值达到274 nmol/L(约合115 mg/dL)时,3种转换方法的表现相似;但当浓度超过这一阈值,差异开始显现,转换方法之间的一致性明显降低(图6)。该研究充分表明,Lp(a)浓度较低情况下,进行近似单位转换具有一定可行性;一旦浓度升高,转换的准确性会大打折扣,存在明显局限性[5]。
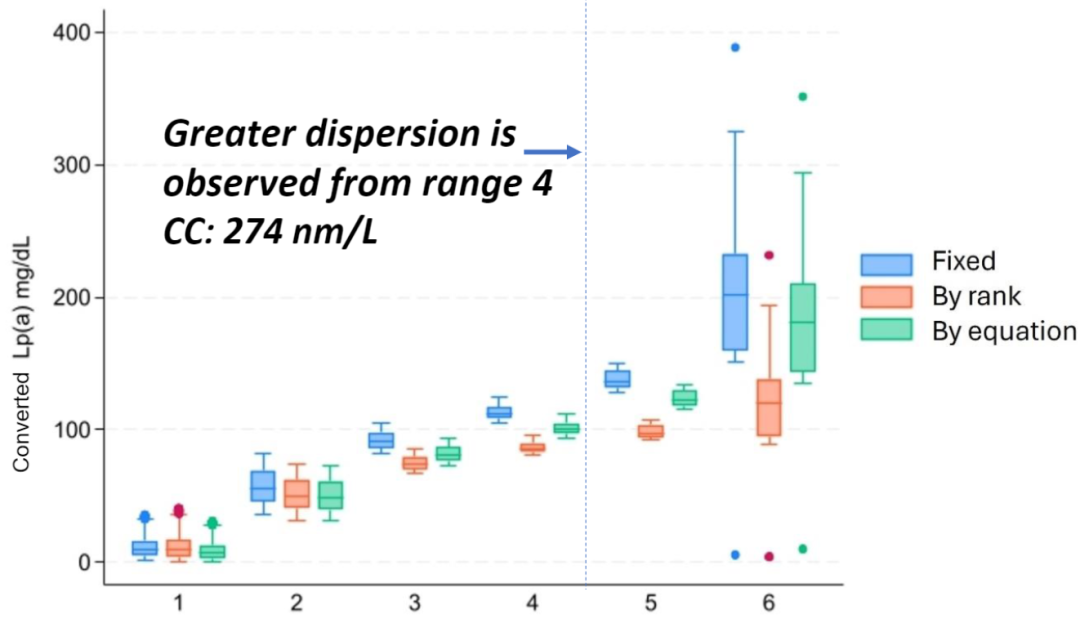
图6. 箱线图显示不同转换方法下的Lp(a)浓度分布
Lp(a)分为以下范围(横坐标):1:<75 nmol/L;2:75~174 nmol/L;3:175~224 nmol/L;4:225~274 nmol/L;5:275~325 nmol/L;6:>325 nmol/L
对于是否应对Lp(a)进行级联筛查,国际指南建议成人一生至少测一次Lp(a),级联筛查对特定人群有潜在价值,但目前Lp(a)检测率极低。本次EAS大会上,伦敦帝国理工学院Jaimini Cegla博士提到,Lp(a)筛查方法包括普遍、选择性和级联筛查,级联筛查借鉴家族性高胆固醇血症(FH)策略,即当有人被确诊,则应对其所有一级家庭成员(父母、同胞和子女)进行筛查,检出率较高。其好处是Lp(a)强遗传性利于早期识别高危亲属并干预,如相关研究显示Lp(a)升高与FH并存时心血管风险更高。但也存在缺乏明确治疗路径、成本效益数据有限、伦理问题等挑战。这提示级联筛查有前景,但仍需更多研究和政策支持[6]。
随着人们对Lp(a)作为ASCVD独立风险因素认识的加深,一项结构化调查[7]在2024年4~7月对44位英国脂质专家进行访谈,并采用定量和定性方法进行分析。结果显示,63%受访者认为Lp(a)检测对全面了解患者心血管风险至关重要,但仅32%受访者会常规检测所有患者。检测的主要原因是评估个体心血管风险和进行早期干预以降低风险。而且,多数受访者表示检测结果会影响患者管理,不过检测存在延迟问题,主要障碍是成本/资源以及缺乏国家指南。该研究表明,英国医疗保健专业人员认可Lp(a)检测的重要性,但目前检测存在差异和阻碍。
Lp(a)研究新视角:变异性与心血管风险评估
Lp(a)研究不断深入进程中,数据的准确性、可靠性以及研究方向的创新性是推动领域发展的核心动力。除了对传统研究内容的持续深耕,新的研究方向不断涌现,为我们理解Lp(a)在CVD中的作用机制和临床意义提供了全新视角。其中,Lp(a)变异性研究以及血脂异常中LDL-C变异性分析作为新兴的研究热点,具有重要的理论和实践价值。
一项英国研究[8]聚焦血脂异常成人的Lp(a)变异性及检测必要性,纳入250例血脂门诊患者,回顾分析至少两次Lp(a)检测数据,通过变异系数(CV)评估个体内变异性,并关联外部因素。结果显示,基线与随访Lp(a)中位数分别为56.0 nmol/L和53.5 nmol/L,个体内生物学CV为15.5%,随访时间、人口学特征、用药等均未显著影响变异性;仅18.8%患者发生CVD风险重新分类,其中2.4%从<90 nmol/L升至≥90 nmol/L。结论指出,Lp(a)水平相对稳定,外部因素影响有限,多数人单次检测即可确定风险,接近阈值者可考虑重复检测。
另一项韩国多中心研究[9]则聚焦Lp(a)高变异性的预测因素及其对风险分层的影响。鉴于Lp(a)变异性的临床意义尚不明确,研究纳入5305例韩国三级医院患者,Lp(a)高变异性定义为绝对变化≥10 mg/dL或相对变化≥25%,比较高低变异组的临床特征,并通过多变量回归分析其预测因素。结果显示,约19.9%患者表现出Lp(a)高变异性,这与高血压、糖尿病、血脂异常和既往卒中等不良心血管特征显著相关。风险重分类分析显示,低危和高危患者在很大程度上保持稳定,但中间“灰色地带”患者中近52%被重分类,突显了Lp(a)检测的动态性。多变量回归分析确定,基线和随访Lp(a)水平、体重指数、血红蛋白、白细胞计数、血小板计数、估算肾小球滤过率、血清葡萄糖及降压药物的使用,是高Lp(a)变异性的重要预测因素(图7)。
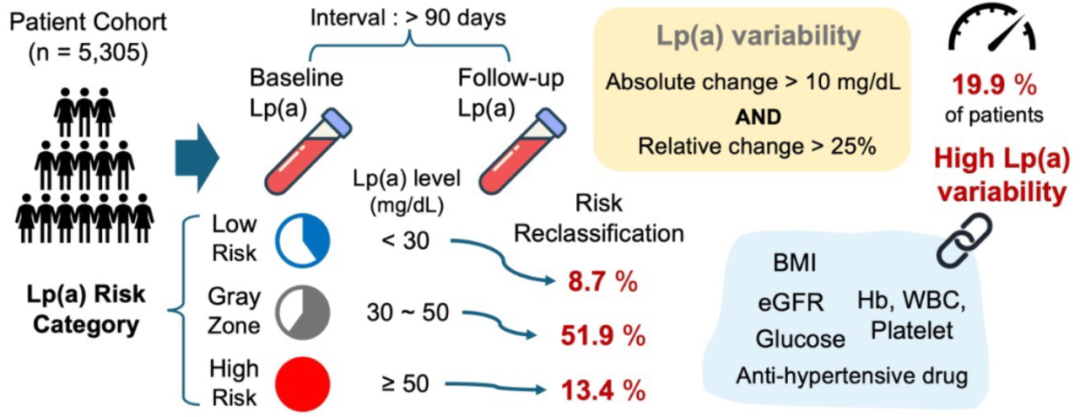
图7. 个体内Lp(a)变异性在心血管风险分层中的工作流程及关键发现
上述两项研究从生物学变异和临床预测因素方面揭示了Lp(a)在风险评估中的价值,其中英国研究支持单次检测的有效性,韩国研究强调监测变异性对优化风险分层的潜力。这些发现为临床实践中合理利用Lp(a)检测、优化个体化风险分层提供了重要参考。
重塑CVD防治格局——基于Lp(a)研究的未来展望
随着Lp(a)研究的持续深入和不断拓展,我们对CVD的认知正在经历深刻变革。基于当前丰富的研究成果,一个具有重大战略意义的问题摆在我们面前:是否应基于Lp(a)水平重构CVD风险评估体系,并对传统LDL-C目标值进行重新评估?
Toscano等人的研究[10]聚焦基于Lp(a)水平重分类心血管风险及评估LDL-C目标值。研究旨在评估不同心血管风险评估临床评分的一致性,探索Lp(a)在不同风险患者中的分布,基于Lp(a)重分类心血管风险并确定高危阈值。研究选取422例门诊患者,收集多项生理及疾病数据,计算多种评分。结果显示,部分评分间存在一致性,患者队列中Lp(a)分布与白种人类似,调整Lp(a)后平均终生心血管风险上升,确定≥114 mg/dL为高危阈值,部分该阈值患者基线LDL-C也较低。由此得出结论,在心血管低危患者中也需考虑Lp(a)的影响。
该研究为心血管风险评估和血脂管理提供了新视角,有望推动临床实践中对Lp(a)的重视和更精准的治疗策略制定。
总结
EAS 2025聚焦Lp(a),展现其在CVD防治领域的研究热度与重要价值。中国科研团队通过对AMI患者的研究,发现Lp(a)升高与冠状动脉粥样硬化斑块特征密切相关,为精准诊疗提供新依据。国际研究从不同人群维度揭示Lp(a)作为独立危险因素的作用。临床应用方面,Lp(a)检测重要性获认可,但面临检测标准化、单位转换准确性等挑战,相关研究为合理检测与风险分层提供参考。未来,基于 Lp(a)研究有望重塑CVD风险评估体系,推动精准防治策略发展。
我要留言