编者按
肿瘤心脏病学(Onco-cardiology)是一个新兴领域,正在日益受到广泛关注。随着肿瘤治疗手段的进步和患者生存期的延长,抗肿瘤治疗引发的心血管损伤问题,以及肿瘤本身对心脏功能的影响,共同构成了肿瘤心脏病学的核心议题。在此背景下,深入探索肺癌心脏病的微环境调控机制,并据此研发新的药物靶点及治疗策略,具有重大的临床意义。广州医科大学药学院院长余细勇教授团队在该领域进行了一系列前沿研究,在第10届肿瘤心脏病学会议(COC2025)上,余细勇教授以《肺癌心脏病的微环境调控靶点与药物研究》为主题进行了分享,为我们揭示了新的方向与可能。
专家简介

余细勇 教授
二级教授、博士生导师
行政职务:广州医科大学药学院院长、广州分子与临床药理学研究所所长,广州医科大学临床药学系主任。同时兼任国家药监局重点实验室主任、广东省重点实验室主任、广州市重点实验室主任、广东省高校重点实验室主任、粤港澳高校联合实验室主任。
研究方向:聚焦肺心轴微环境的靶点与新药研发,开展表观遗传药理学、分子临床药理学、分子药剂生物学研究。
社会职务:现任中国药理学会副理事长、中国药理学会表观遗传药理学专业委员会主任委员,国际肿瘤心脏病学会(IC-OS)理事,国际心脏研究会(ISHR)中国转化医学工作委员会名誉主任委员,美国基因与细胞治疗学会官方杂志MolecularTherapy(IF12.1)的副主编;广东省药理学会理事长/监事长,广东省药品监管科学学会副会长。
学术成果:发表学术论文近600篇(其中SCI论文260篇,IF>10的论文80多篇),被引近1.5万次,H指数56。主编学术专著4部、主编副主编教材3部。先后主持国家自然科学基金重点项目3项、国家973项目1项、国家重点研发计划1项(首席)。申请并获得授权国内外(含欧美等国家)发明专利40多项,牵头创办药学院科技成果转化平台1个。主持获得省部级科技成果一等奖2项、二等奖3项,医学科学奖5项,瑞士日内瓦国际发明金奖1项,美国硅谷国际发明银奖1项,英国伦敦国际发明金奖1项,华夏医学科技奖1项,中国产学研合作创新成果奖1项。2个国家一流专业和2门国家一流课程负责人。连续多年入选Stanford-Elservier药学全球前2%顶尖科学家榜,以及ESI多学科全球前2%顶尖科学家榜单。
所获荣誉:国务院政府特殊殊津贴专家,国家心血管专家委员会委员,国家药监局CDE评审专家。俄罗斯工程院(RAE)外籍院士、欧洲自然科学院(EANS)院士。广东省卫生系统“五个一科教兴医工程”学术与技术带头人,第八届广东省丁颖科技奖,南粤优秀教育工作者,广州医科大学黄大年式教师团队负责人,广州最美科技工作者。
肿瘤心脏病学概况与挑战
肿瘤治疗药物,包括细胞毒类药物、抗血管生成药物及免疫检查点抑制剂等,均可引发不同类型的心脏毒性,抗肿瘤治疗引起的心血管损伤已成为肿瘤长期生存者的第二大死因。
肺癌作为一种高发恶性肿瘤,不仅在其治疗过程伴随着心脏损伤的风险,研究表明肺癌本身也是心血管疾的独立危险因素,其调整后风险比(aHR)为1.27(95%CI:1.19~1.36)(图1)[1]。课题组进一步发现,调节性T淋巴细胞(Tregs)和tRNA衍生片段/tRNA半分子(tRFs/tiRNAs)参与了肺癌心脏损伤的发生发展调控。例如,在接受靶向治疗并发心肌炎的患者中,外周血Tregs比例显著高于非心肌炎组(24.79±7.72% vs. 17.55±6.59%,P<0.01);对肺癌心脏组织进行tRFs/tiRNAs测序,鉴定出22个上调的和16个下调的tRFs/tiRNAs。

图1. 肺癌心脏病的发生率
然而,目前肿瘤心脏病领域仍面临预警标准不统一、防治手段进展缓慢、生物标志物缺乏及无特异性防治药物等诸多挑战,将研究焦点转向“肺癌心脏病及其微环境”或成为突破口。
为深入研究肺癌心脏病的复杂机制,研究团队使用乌拉坦联合苯并芘诱导的Balb/c小鼠建立了肺癌心脏病动物模型。病理学分析显示,乌拉坦联合苯并芘诱导的肺癌以中分化肺腺癌为主。重要的是,该模型的右心功能呈现显著下降,并且出现了显著的心包钙化改变(图2)[2],为后续的机制研究和药物评价奠定了基础。

图2. 肺癌心脏病模型的心包钙化改变
探秘肺癌心脏病的微环境
心肺祖细胞(CPPs)的修复潜力
心肺的共同发育微环境为我们提供了新的视角[3,4]。课题组成功从E9.5小鼠胚胎中分离并扩增了CPPs。这些CPPs具有心、肺双谱系分化潜能,可分化为成纤维细胞(74.7%)、心肌细胞(75.4%)、内皮细胞(92.7%)、平滑肌细胞(88.5%)和II型肺泡上皮细胞(47.9%)。单细胞测序(scRNA-seq)显示,CPPs中心肌细胞和成纤维细胞占比最高[5]。
进一步研究发现,CPPs外泌体(CPPs-Exo)富含具有心肌保护和血管新生潜力的miRNA。在心肌梗死(MI)雌性小鼠模型中,注射CPPs外泌体不会产生畸胎瘤,能显著改善心功能(左心射血分数和缩短分数上升)并减少心脏纤维化程度,而这种作用可被外泌体抑制剂GW4869削弱,证实了CPPs外泌体在心脏修复中发挥重要作用[5]。
基于此,团队也成功通过CRISPR/dCa9/SAM表观重编程技术将人心脏成纤维细胞(HCF)重编程为诱导的心肺祖细胞(iCPPs),其同样具有心、肺双谱系分化能力(图3)[6]。iCPPs的研制为肺癌心脏病的防治开辟了新途径。
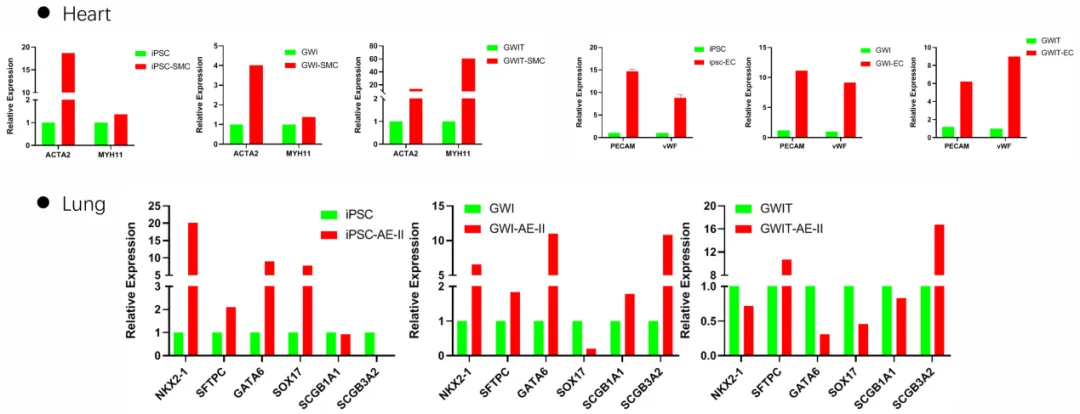
图3. iCPPs的心、肺双谱系分化能力
Gli1+细胞在肺癌心脏病中的双重角色
作为共同成年组织微环境中的关键角色,Gli1+细胞不仅在心肌纤维化中发挥重要作用[7,8],在非小细胞肺癌(NSCLC)组织中也高水平表达(图4)。研究发现,过表达Gli1能促进NSCLC的转移,且转录因子Snail在此过程中扮演重要角色,Gli1通过Snail促进NSCLC的上皮间充质转化(EMT)[9]。这些发现提示Gli1可能成为连接肺癌进展与心脏损伤的潜在靶点。
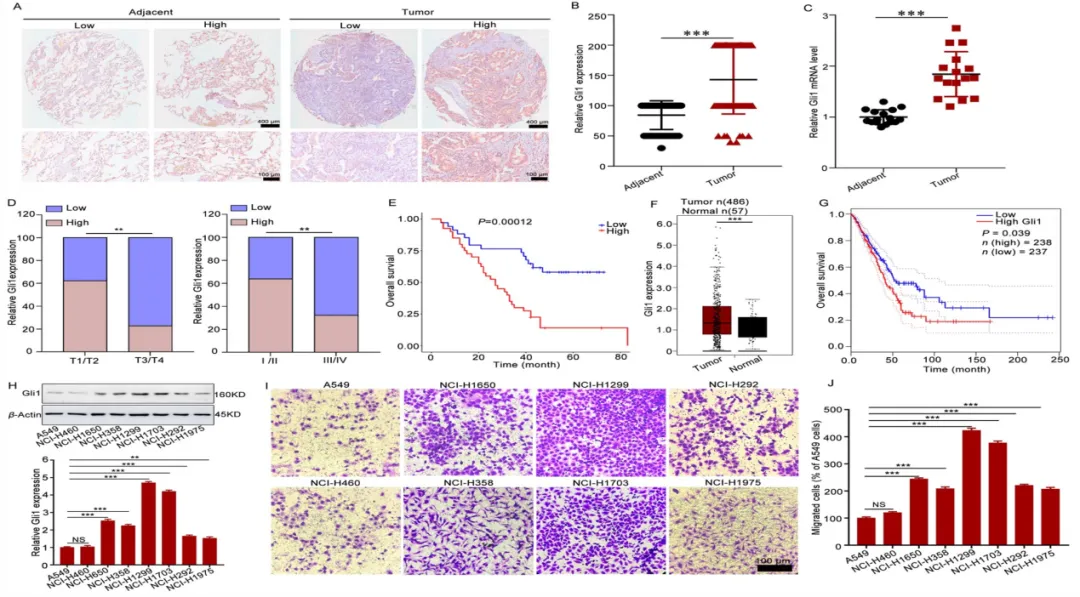
图4. Gli1在非NSCLC组织中的高水平表达
此外,扁蒴藤素被发现能抑制周细胞中的Shh/Gli1信号通路,从而影响新生血管的成熟[10]。
微环境调控药物的研发与突破
人工外泌体改善心肺微环境
鉴于天然外泌体的复杂性与产量限制,人工外泌体作为药物递送载体展现出巨大潜力。研究团队成功构建了人工外泌体用于药物递送,例如,递送靶向Polo样激酶1(PLK1)的siRNA可有效治疗肺癌[11]。
更值得关注的是,当利用人工外泌体递送Gli1-shRNA治疗肺癌动物模型时,不仅观察到肿瘤抑制效果,还伴随了心功能的显著改善(图5),这为肺癌心脏病的“一箭双雕”治疗策略提供了新思路。

图5. 人工外泌体Gli1-shRNA治疗肺癌时伴随心功能改善
调控微环境的表观药物筛选
心肌梗死后心肌细胞再生能力极低是导致心力衰竭的关键因素。Hippo信号通路及其下游效应分子YAP是调控细胞增殖与再生的重要通路。课题组建立了基于YAP信号通路的高通量筛选平台,旨在寻找能够促进心肌细胞再生的小分子调节剂。通过多轮筛选和浓度梯度测试,成功鉴定出候选化合物YA-193。核-质易位实验表明,YA-193可以促进心肌细胞中YAP的核转位。
在小鼠心肌梗死模型中,YA-193能够促进心肌再生,并显著减少心脏的纤维化面积,显示出良好的临床转化前景。
总结与展望
研究系统地揭示了肺癌心脏病微环境的复杂调控网络,从建立创新性的动物模型,到深入解CPPs及其外泌体的修复机制、Gli1+细胞在肿瘤进展和心脏纤维化中的作用,再到开发基于人工外泌体的精准药物递送系统和通过高通量筛选发现促进心肌再生的新型小分子化合物,均取得了令人鼓舞的进展。
这些研究不仅为理解肺癌心脏病的发病机制提供了新见解,更为开发特异性的诊断生物标志物和有效的治疗药物开辟了新途径,有望改变当前肿瘤心脏病领域面临的困境,最终惠及广大患者。
参考文献:
[1] Yoon DW, et al. Increased risk of coronary heart disease and stroke in lung cancer survivors: A Korean nationwide study of 20,458 patients. Lung Cancer. 2019 Oct;136:115-121.
[2] Wu Q, et al. A novel onco-cardiological mouse model of lung cancer-induced cardiac dysfunction and its application in identifying potential roles of tRNA-derived small RNAs. Biomed Pharmacother. 2023 Sep;165:115117.
[3] Peng T, et al. Coordination of heart and lung co-development by a multipotent cardiopulmonary progenitor. Nature. 2013 Aug 29;500(7464):589-92.
[4] Steimle JD, et al. Evolutionarily conserved Tbx5-Wnt2/2b pathway orchestrates cardiopulmonary development. Proc Natl Acad Sci U S A. 2018 Nov 6;115(45):E10615-E10624.
[5] Xiao YY, et al. Cardiopulmonary progenitors facilitate cardiac repair via exosomal transfer of miR-27b-3p targeting the SIK1-CREB1 axis. Cell Prolif. 2024 May;57(5):e13593.
[6] Xia LX, et al. Exosomes derived from induced cardiopulmonary progenitor cells alleviate acute lung injury in mice. Acta Pharmacol Sin. 2024 Aug;45(8):1644-1659.
[7] Kim J, Braun T. Targeting the cellular origin of organ fibrosis. Cell Stem Cell. 2015 Jan 8;16(1):3-4.
[8] Xiao J, et al. Cardiac progenitor cell-derived exosomes prevent cardiomyocytes apoptosis through exosomal miR-21 by targeting PDCD4. Cell Death Dis. 2016 Jun 23;7(6):e2277.
[9] Lei X, et al. Gli1 promotes epithelial-mesenchymal transition and metastasis of non-small cell lung carcinoma by regulating snail transcriptional activity and stability. Acta Pharm Sin B. 2022 Oct;12(10):3877-3890.
[10] Lei X, et al. Gli1-mediated tumor cell-derived bFGF promotes tumor angiogenesis and pericyte coverage in non-small cell lung cancer. J Exp Clin Cancer Res. 2024 Mar 16;43(1):83.
[11] Zhang L, et al. Homotypic Targeting Delivery of siRNA with Artificial Cancer Cells. Adv Healthc Mater. 2020 May;9(9):e1900772.
我要留言