近日,Am Heart J Plus杂志刊载了一篇文章,通过44岁女性早发冠心病病例,揭示脂蛋白(a)[Lp(a)]作为动脉粥样硬化性心血管疾病(ASCVD)独立危险因素的临床意义[1]。患者虽年轻且传统风险因素中等,却因Lp(a)显著升高、家族史及高血压,快速进展为严重冠脉狭窄,凸显Lp(a)筛查对早期识别ASCVD高危人群的关键价值。研究指出,Lp(a)风险常被传统评估工具低估,尤其绝经前女性需重点关注。尽管当前靶向治疗有限,但新型药物已展现显著降Lp(a)效果,提示临床应推进Lp(a)常规筛查,以优化ASCVD一级预防策略。
重点摘要
Lp(a)水平升高是动脉粥样硬化性心血管疾病的独立危险因素。
绝经前女性与男性同样可能因Lp(a)水平升高而面临更高的心血管风险。
风险评估计算器可能低估Lp(a)升高患者的疾病风险。
临床应筛查Lp(a)水平异常,以实现冠状动脉疾病的早期识别。
病例报告
患者,女性,44岁,因高血压及心血管风险评估就诊心内科。既往有阵发性室上性心动过速(β受体阻滞剂间断治疗)、雷诺现象、情境性焦虑及轻度体位性睡眠呼吸暂停。4次妊娠史(1次流产,3次剖宫产),每次妊娠合并高血压,产后接受6~8周利尿剂治疗,曾长期使用激素类避孕药。BMI 20 kg/m2,HbA1C 5.5%。家族史:母亲62岁因严重高胆固醇血症行冠脉搭桥术(早发冠状动脉粥样硬化性心脏病),父亲患高血压。
初诊用药:酒石酸美托洛尔25 mg(按需止悸)、西酞普兰10 mg/d(抗焦虑)。动态血压监测确诊2级高血压(总体148/104 mmHg),予氨氯地平5 mg/d,后血压控制至120/79 mmHg。
心脏超声示射血分数60%~65%,心功能正常。血脂检查:总胆固醇180 mg/dl,低密度脂蛋白胆固醇(LDL-C)108 mg/dl,Lp(a) 219 nmol/L(高危)。基因检测显示LPA及ABCA6基因杂合变异。启动瑞舒伐他汀10 mg治疗。
4个月后出现进食后上腹痛,冠状动脉计算机断层扫描血管造影(CTA)示冠脉钙化积分318,左前降支(LAD)近端狭窄60%,右冠状动脉(RCA)狭窄50%,瑞舒伐他汀增至20 mg,LDL-C降至62 mg/dl,因不耐受依折麦布未用。
7个月后跑步时突发胸痛,放射至左肩,急诊造影示LAD近端95%狭窄,行经皮冠状动脉介入治疗(PCI)治疗。因Lp(a)升高、家族史及冠状动脉粥样硬化性心脏病(CAD)快速进展,加用PCSK9抑制剂依洛尤单抗(140 mg每2周一次)。尽管患者年龄较轻,但其钙化斑块负荷复杂且可能长期存在。其CAD可能由Lp(a)升高、高血压及家族史共同导致。
Lp(a):ASCVD独立危险因素的多维解析与早期筛查价值
心血管疾病(CVD)是人类健康主要威胁之一,早期识别高危个体并干预至关重要。传统动脉粥样硬化性心血管疾病(ASCVD)危险因素包括高龄、吸烟、高血压等,而Lp(a)已被确认为ASCVD的独立因果危险因素,尤其与绝经前女性CVD风险增加相关。本病例凸显Lp(a) 筛查对早期强化CVD预防的价值。
从结构看,Lp(a)由载脂蛋白(a)[apo(a)]通过二硫键与载脂蛋白B-100(apoB-100)结合组成,与纤溶酶原结构相似(共享94%氨基酸),可能干扰纤溶活性并增加血栓风险[2,3]。其合成独立于LDL-C,分解代谢机制尚不明确,肾脏可能参与其中。
Lp(a)受遗传决定,>90%的变异由LPA基因控制。非洲和南亚人群的Lp(a)水平高于欧洲和东亚人群,但不同种族中Lp(a)与心血管风险的关联相似。小apo (a)异构体可导致Lp(a)水平显著升高。因Lp(a)水平一生相对稳定,单次测量即可用于风险评估,基因检测虽有价值,但成本可能限制其应用。
某些疾病影响Lp(a)水平:肾脏疾病中,肾小球滤过率(GFR)下降可使Lp(a)升高,肾病综合征患者Lp(a)可达对照组3~5倍,透析进一步升高其水平,肾移植可使其正常化[4];甲状腺功能亢进/减退分别与Lp(a) 降低/升高相关,治疗后可恢复基线[5]。
综上,Lp(a) 作为ASCVD独立危险因素,其结构、遗传特性及疾病关联为CVD风险分层和干预提供了新方向。标准化测量和早期筛查有助于优化高危人群的预防策略。尽管生活方式干预尚未显示能显著降低Lp(a)水平,但最近一项研究表明低碳水化合物饮食可能提供一定益处[6]。此外,二十碳五烯酸乙酯干预试验(REDUCE-IT)的结果支持在各种Lp(a)水平下减少主要不良心血管事件的证据[7]。
Lp(a)与心血管风险:致病机制、疾病关联及干预必要性
深入理解Lp(a)对CVD的病理机制,是开发有效干预措施的关键。Lp(a) 兼具LDL的致动脉粥样硬化特性,其携带的apo(a)可能介导动脉粥样硬化与血栓形成的关联。机制上,Lp(a)通过携带氧化磷脂(oxPLs)触发单核细胞活化、促进炎症因子释放,还可通过PFKFB3通路增强内皮细胞糖酵解活性,加剧炎症反应。
Lp(a)水平升高与CAD、缺血性脑卒中、主动脉瓣狭窄(AS)等CVD风险增加显著相关。多项研究证实,Lp(a)升高与CAD风险的关联独立于LDL-C,他汀类药物虽能降低LDL-C,但无法改善Lp(a)相关风险。
此外,Lp(a)可促进主动脉瓣钙化,独立于CAD进程。鹿特丹研究发现,Lp(a)与主动脉瓣钙化的基线水平和新发事件相关,但不影响已存在钙化的进展速度[8]。这些证据支持对高Lp(a) 人群进行早期筛查及干预,以降低CVD风险。
Lp(a) 对女性心血管健康的影响:性别差异与绝经因素的双重作用
Lp(a)作为独立ASCVD危险因素在女性中的预测价值具有独特性(图1)。研究显示,Lp(a)水平≥50 mg/dl会增加男女两性的CAD风险,而Lp(a)≥30 mg/dl仅在女性中具有预测意义。此外,50岁及以上女性的Lp(a)浓度略高于同龄男性,进一步凸显了Lp(a)的影响。近期研究指出,Lp(a)浓度在出生时较低,在出生后2年内达到稳定水平,并可能在孕期和更年期升高[9]。
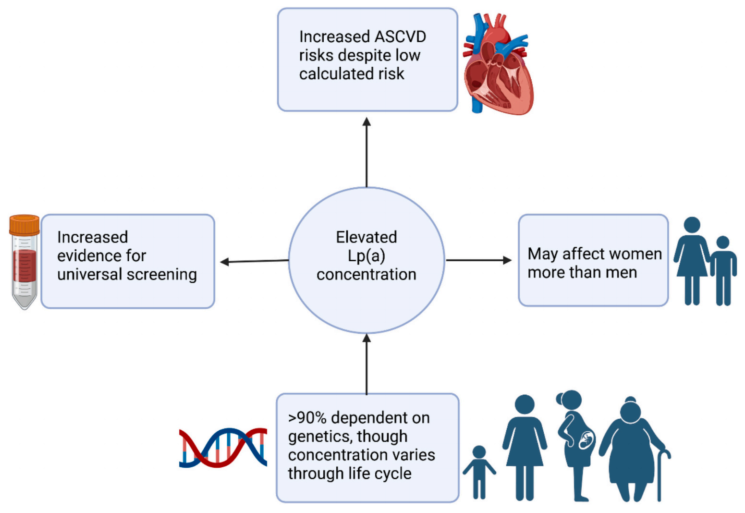
图1. Lp(a)升高对女性心血管风险的影响示意图
(图片摘自:American Heart Journal Plus: Cardiology Research and Practice 56 ,2025: 100560)
尽管有观点认为Lp(a)升高对女性的影响可能更大,甚至存在性别特异性的Lp(a)水平解读阈值,但最近一项来自6项安慰剂对照他汀试验的Meta分析(N=27,658)显示,Lp(a)与性别在ASCVD风险上无显著交互作用(P=0.310),男女风险结局相似[10]。此外,考虑到该患者44岁的相对年轻年龄,其与Lp(a)和LDL-C的关系与年龄≤中位值63岁的人群相似(P=0.710)。本病例聚焦于绝经前女性,这与大多数成人心脏科医生在临床实践中可能遇到的情况类似。
绝经状态也对Lp(a)在女性CVD风险中的作用产生独特影响。一项Meta分析显示,绝经后女性的Lp(a)浓度高于绝经前女性[11]。另一方面,雌激素激素替代疗法(即使低剂量)已被证明可降低Lp(a)水平[12],但衰老仍可能是其升高的主要原因[11]。需进一步研究以明确绝经后女性Lp(a)升高的潜在机制。
当前推荐与治疗现状:指南共识与实践挑战
鉴于Lp(a)作为独立ASCVD危险因素的认知不断提升,且欧洲、加拿大和美国国家脂质协会等机构已发布科学声明,Lp(a)检测的应用可能在近期扩展。美国心脏病学会(ACC)和美国心脏协会(AHA)2018年多学会指南将Lp(a)≥50 mg/d/或≥125 nmol/L列为风险增强因素[13]。欧洲动脉粥样硬化学会(EAS)共识声明建议,对CVD高风险个体或有早发性CVD显著家族史者进行Lp(a)检测[4]。EAS将< 30 mg/dl视为Lp(a)正常水平,>50 mg/dl(第80百分位数)为CVD高风险,并建议30~50 mg/dl的中间水平需结合其他传统危险因素综合评估。
目前,降低高Lp(a)患者CVD风险的最佳策略是控制传统危险因素并靶向LDL-C /apoB。根据CAC评分和CT结果考虑阿司匹林等抗血小板治疗时,需平衡潜在获益与出血风险。多民族动脉粥样硬化研究(MESA)数据显示,Lp(a)>50 mg/dl者使用阿司匹林可使CAD事件风险降低46%[14],但同时也与严重出血并发症相关。
目前尚无美国食品药品监督管理局(FDA)专门批准用于治疗Lp(a)升高的药物。唯一可用的治疗是脂蛋白单采术(lipoprotein apheresis),FDA批准其用于家族性高胆固醇血症患者[15]。但仍需更多数据验证Lp(a)单采术在降低CVD发生率中的有效性。另一种潜在方法是使用PCSK9抑制剂降低LDL-C,可使Lp(a)减少20%~25%[15,16]。此外,他汀类药物对Lp(a)水平的影响研究结果不一:早期试验显示轻微降低,近期Meta分析则提示轻微升高或无临床显著变化[16]。
干预的未来方向:新型疗法与临床试验的突破曙光
为应对Lp(a)升高带来的CVD风险,目前正在开展开发和评估降低Lp(a)水平策略的研究。多种前景广阔的疗法正在探索中,包括pelacarsen(一种抑制Lp(a)基因mRNA生成的单链反义寡核苷酸)[17]。此外,小干扰RNA(siRNA)如olpasiran、zerlasiran、lepodisiran可抑制mRNA生成,而muvalaplin则通过阻止Lp(a)形成发挥作用。其中,pelacarsen、olpasiran、zerlasiran和lepodisiran通过皮下注射给药,muvalaplin为口服制剂。
近期Ⅱ期试验已证实这些疗法的有效性:Pelacarsen可使Lp(a)水平降低达80%[18]。在一项纳入281例ASCVD合并高Lp(a)(>150 nmol/L)患者的Ⅱ期试验中,olpasiran在225 mg剂量下每12周和24周给药,经安慰剂校正后Lp(a)水平分别显著降低101.1%和100.5%(与基线相比,P均< 0.0001)[19]。另一项Ⅱ期试验显示,最高剂量的lepodisiran可使Lp(a)水平降低94%[20]。
Muvalaplin在一项全球Ⅱ期安慰剂对照随机双盲试验(N=233)中也展现了前景,该试验纳入Lp(a)≥175 nmol/L合并ASCVD、糖尿病或家族性高胆固醇血症的患者[21]。结果显示,最高剂量的muvalaplin经安慰剂校正后使Lp(a)降低达85.8%(95% CI:83.1%~88.0%)。
最新一项针对178例稳定型ASCVD且Lp(a)≥125 nmol/L患者的Ⅱ期试验显示,zerlasiran耐受性良好,在36周内使Lp(a)的时间平均水平降低> 80%[22]。
基于上述发现,多项Ⅲ期试验正在进行中:Pelacarsen在HORIZON试验中评估,该试验纳入8323名参与者,预计2026年完成[17]。其他Ⅲ期试验包括olpasiran的OCEAN (a) 试验和lepodisiran的ACCLAIM-Lp(a)试验[17]。
总结
本病例报告显示,尽管传统评估的ASCVD风险较低,Lp(a)仍可能对早发性、常为重度的冠心病产生深远影响。作为强效心血管危险因素,目前普通人群中仅<
1%接受Lp(a)检测。临床医生应推广Lp(a)普遍筛查,尤其是绝经前女性,其ASCVD风险常被传统风险计算器低估。尽管目前尚无专门靶向Lp(a)的获批治疗,识别高危个体可通过常规手段早期干预,降低其冠心病相关并发症风险。该方法可确保正确诊断、及时治疗并潜在挽救生命。此外,本病例支持进一步研究以明确Lp(a)的心血管风险,并在临床试验中纳入女性及多样化人群。
参考文献:
1.Nguyen Yen Nhi Ngo, et al. Lipoprotein(a) and coronary artery disease: The need for universal screening–A case-based review.Am Heart J Plus.2025 Jun 1;56:100560.
2.Tsimikas S. A test in context: lipoprotein(a): diagnosis, prognosis, controversies, and emerging therapies. J. Am. Coll. Cardiol. 2017;69(6):692–711.
3.Tasdighi E., Adhikari R., Almaadawy O., Leucker T.M., Blaha M.J. LP(a): structure, genetics, associated cardiovascular risk, and emerging therapeutics. Annu. Rev. Pharmacol. Toxicol. 2024;64(1):135–157.
4.Kronenberg F., et al. Lipoprotein(a) in atherosclerotic cardiovascular disease and aortic stenosis: a European Atherosclerosis Society consensus statement. Eur. Heart J. 2022;43(39):3925–3946.
5.Kotwal A., et al. Treatment of thyroid dysfunction and serum lipids: a systematic review and meta-analysis. J. Clin. Endocrinol. Metab. 2020;105(12):3683–3694.
6.Ebbeling C.B., et al. Effects of a low-carbohydrate diet on insulin-resistant dyslipoproteinemia—a randomized controlled feeding trial. Am. J. Clin. Nutr. 2021;115(1):154–162.
7.Szarek M., et al. Lipoprotein(a) blood levels and cardiovascular risk reduction with icosapent ethyl. J. Am. Coll. Cardiol. 2024;83(16):1529–1539.
8.Kaiser Y., et al. Lipoprotein(a) is associated with the onset but not the progression of aortic valve calcification. Eur. Heart J. 2022;43(39):3960–3967.
9.Pablo C., et al. Lipoprotein(a) throughout life in women. Am. J. Prev. Cardiol. 2024:100885.
10.Bhatia H.S., et al. Independence of lipoprotein(a) and low-density lipoprotein cholesterol-mediated cardiovascular risk: a participant-level meta-analysis. Circulation. 2024
11.Anagnostis P., Antza C., Trakatelli C., Lambrinoudaki I., Goulis D.G., Kotsis V. The effect of menopause on lipoprotein (a) concentrations: a systematic review and meta-analysis. Maturitas. 2023;167:39–45.
12.Anagnostis P., et al. The effect of hormone replacement therapy and tibolone on lipoprotein (a) concentrations in postmenopausal women: a systematic review and meta-analysis. Maturitas. 2017;99:27–36.
13.Grundy S.M., et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA guideline on the management of blood cholesterol: a report of the American College of Cardiology/American Heart Association task force on clinical practice guidelines. Circulation. 2019;139(25):e1082–e1143.
14.Bhatia H.S., et al. Aspirin and cardiovascular risk in individuals with elevated lipoprotein(a): the multi-ethnic study of atherosclerosis. J. Am. Heart Assoc. 2024;13(3) .
15.CDC, About Lipoprotein (a), Heart Dis. Fam. Health Hist. Fam. Hypercholesterolemia. Accessed: Mar. 03, 2025. [Online].
16.Kaur G., et al. Lipoprotein(a): emerging insights and therapeutics. Am. J. Prevent. Cardiol. 2024;18.
17.Nordestgaard B.G., Langsted A. Lipoprotein(a) and cardiovascular disease. Lancet. 2024;404(10459):1255–1264.
18.Tsimikas S., et al. Lipoprotein(a) reduction in persons with cardiovascular disease. N. Engl. J. Med. 2020;382(3):244–255. doi: 10.1056/NEJMoa1905239.
19.O’Donoghue M.L., et al. Small interfering RNA to reduce lipoprotein(a) in cardiovascular disease. N. Engl. J. Med. 2022;387(20):1855–1864.
20.Nissen S.E., et al. Lepodisiran, an extended-duration short interfering RNA targeting lipoprotein(a): a randomized dose-ascending clinical trial. JAMA. 2023;330(21):2075.
21.Nicholls S.J., et al. Oral muvalaplin for lowering of lipoprotein(a): a randomized clinical trial. JAMA. 2024.
22.Nissen S.E., et al. Zerlasiran-a small-interfering RNA targeting lipoprotein(a): a phase 2 randomized clinical trial. JAMA. 2024

我要留言